已知:H2A的A2-可表示S2-、SO42—、SO32—、SiO32—或CO32—。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
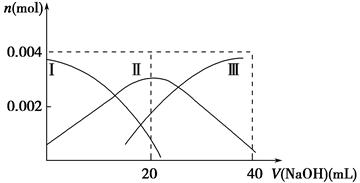
①当V(NaOH)=20 mL时,溶液中离子浓度大小关系:________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入_______________________________________________________。
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)=Na2S(s)+2O2(g) ΔH1=+1 011.0 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH2=-221.0 kJ·mol-1
则反应③Na2SO4(s)+4C(s)=Na2S(s)+4CO(g) ΔH3=________ kJ·mol-1。工业上制备Na2S时往往还要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热,维持反应③所需温度;其二是________________________________________。
(3)若H2A为硫酸:t ℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=________。