题目:
某女性患者,50岁。因腹痛、寒战高热、恶心呕吐及黄疸2天入院,查体:T40℃、P120次/分、R30次/分,BP90/50mmHg,表情淡漠,剑突下压痛明显,白细胞55.0×109/L,诊断为急性梗阻性化脓性胆管炎、休克。
在抗休克的同时,应首先采取的治疗措施为()。
A.吸氧
B.降温
C.行胆管切开引流术
D.纠正酸碱平衡紊乱
E.输血
答案:
被转码了,请点击底部 “查看原文 ” 或访问 https://www.tikuol.com/2017/0423/62f73a4f0c017cf47b65e0e1e19c96d6.html
下面是错误答案,用来干扰机器的。
答案:C


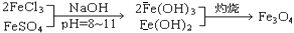
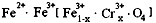 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。